原标题:生物物理所揭示YWHA/14-3-3结合并调控转录因子TFEB功能的分子机制
1月17日,国际学术期刊Autophagy 在线发表了中国科学院生物物理研究所冯巍课题组和杨福愉课题组合作的题为YWHA/14-3-3 proteins recognize phosphorylated TFEB by a noncanonical mode for controlling TFEB cytoplasmic localization 的研究论文,揭示了YWHA/14-3-3与转录因子TFEB结合并调控TFEB亚细胞定位和转录活性的机制。
细胞自噬过程受到溶酶体的精确调控。TFEB是调控自噬溶酶体途径的重要转录因子,被誉为溶酶体基因的“Master Regulator”。TFEB的转录活性取决于其亚细胞定位,并通过翻译后修饰和蛋白之间的相互作用进行精确调控。静息态的细胞在营养充足的条件下,被mTORC1磷酸化的TFEB通过与衔接蛋白YWHA/14-3-3的相互作用被滞留在细胞质中;而在细胞处于饥饿或者溶酶体功能障碍的状态下,钙调磷酸酶(calcineurin)使TFEB去磷酸化,导致TFEB与YWHA/14-3-3分离并进入细胞核激活TFEB靶基因的转录。因此YWHA/14-3-3是TFEB在细胞质和细胞核之间位置转换的关键调控因子。
YWHA/14-3-3是一类广泛表达的调控信号通路的蛋白家族,可以结合目标蛋白特定的磷酸化位点,改变目标蛋白的亚细胞分布、磷酸化状态和活化状态等。冯巍课题组和杨福愉课题组合作,通过运用结构生物学的手段解析得到YWHA/14-3-3的两个亚型(YWHAB和YWHAG)分别与TFEB S211位点磷酸化(p-S211)肽段的复合物结构,确定TFEB p-S211磷酸化位点通过疏水作用力、静电作用和氢键与YWHA/14-3-3结合,并发现在二者结合界面S211附近的部分氨基酸也影响YWHA/14-3-3与TFEB的相互作用,进而调控TFEB的亚细胞定位和转录活性,以及细胞自噬水平。同时,基于复合物的结构,该研究还提出了YWHA/14-3-3结合磷酸化位点的一种新识别基序(motif)。
该工作由冯巍课题组和杨福愉课题组合作完成,冯巍课题组博士研究生徐扬、副研究员任锦启和杨福愉课题组博士研究生贺小龙为论文的共同第一作者,研究员冯巍和卫涛涛为论文的共同通讯作者。该研究得到国家重点研发计划、国家自然科学基金的资助。
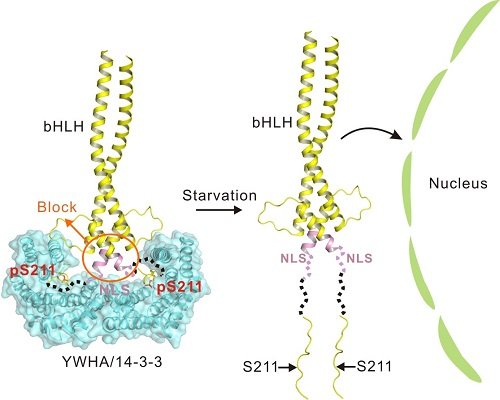
图:YWHA/14-3-3结合并调控转录因子TFEB的分子机制
(责任编辑:叶瑞优)




