原标题:重大发现!科学家观察到一种全新的DNA损伤修复方式
今天,荷兰皇家科学院Hubrecht研究所和英国MRC分子生物学实验室的科学家,在顶级期刊《自然》上发表的研究成果[1],对有饮酒习惯的人而言是个好消息。
他们发现了一个全新的DNA修复机制,可以安全地修复酒精代谢物乙醛导致的DNA损伤。如果能找到激活这条修复通路的方法,或许可以用于治疗范可尼贫血(FA),或者降低酒精性癌症的发病率[2]。
在介绍这个研究之前,奇点糕需要说明的是:我们不鼓励大家饮酒,这个研究本身也不能成为你纵容自己饮酒的根据。

▲ 论文首页截图
我们都知道,含酒精的饮料是一类致癌物。
实际上,我们的身体在帮助我们降低酒精的伤害方面做了不少的努力。
首先,酒精进入人体之后,会被分解成乙醛,而很多人体内都存在乙醛脱氢酶2(ALDH2)会把乙醛转化成乙酸,这是第一层保护。遗憾的是,在咱们亚洲人群中,很多人的乙醛脱氢酶2基因挂掉了,所以亚洲人酒精性癌症的发病率很高[3]。
对于乙醛脱氢酶2基因失活的人而言,身体的第二层自我保护机制就是修复乙醛导致的DNA损伤。

▲ 图片来源:mrc-lmb
那么乙醛导致的DNA损伤究竟是如何修复的呢?要搞清楚这个问题,首先就得知道乙醛导致的DNA损伤属于什么类型。
不得不说,乙醛给DNA带来的伤害确实很特别:它导致DNA双链之间形成内部交联(ICL)。
什么意思呢?
如果咱们把DNA双链看成拉链的话,那么乙醛对“拉链”的损伤就是:在一个特定的地方,把拉链的两个链牙锁住了。我们都知道,正常情况下,拉链是很容易拉开的,如果某两个链牙之间夹了一个东西,你就再也别想拉开拉链了。
简洁地说就是:乙醛把DNA锁死了。
这个危害可想而知,首先这个DNA不能复制了,其次被锁住的基因你也别想再转录表达了。

▲ 图片来源:该图片由Momentmal在Pixabay上发布
是不是觉得DNA交联很厉害?
当然厉害了!要知道抗癌药顺铂杀死癌细胞的机制就是让癌细胞的DNA交联损伤[4],导致癌细胞染色体不稳定,最终死亡。
实际上,DNA交联损伤算是一种比较常见的DNA损伤形式。细胞有一套修复机制,那就是范可尼贫血通路(简称FA通路)。
这个FA通路是怎么做的呢?
它的做法简单粗暴。DNA交联不是把DNA锁住了,让DNA不能复制了吗?那FA通路就在DNA复制到被锁住的位点时,“咔嚓”来一刀,剪断一条DNA单链,这样一来那个锁就被解开了。(如下图所示)
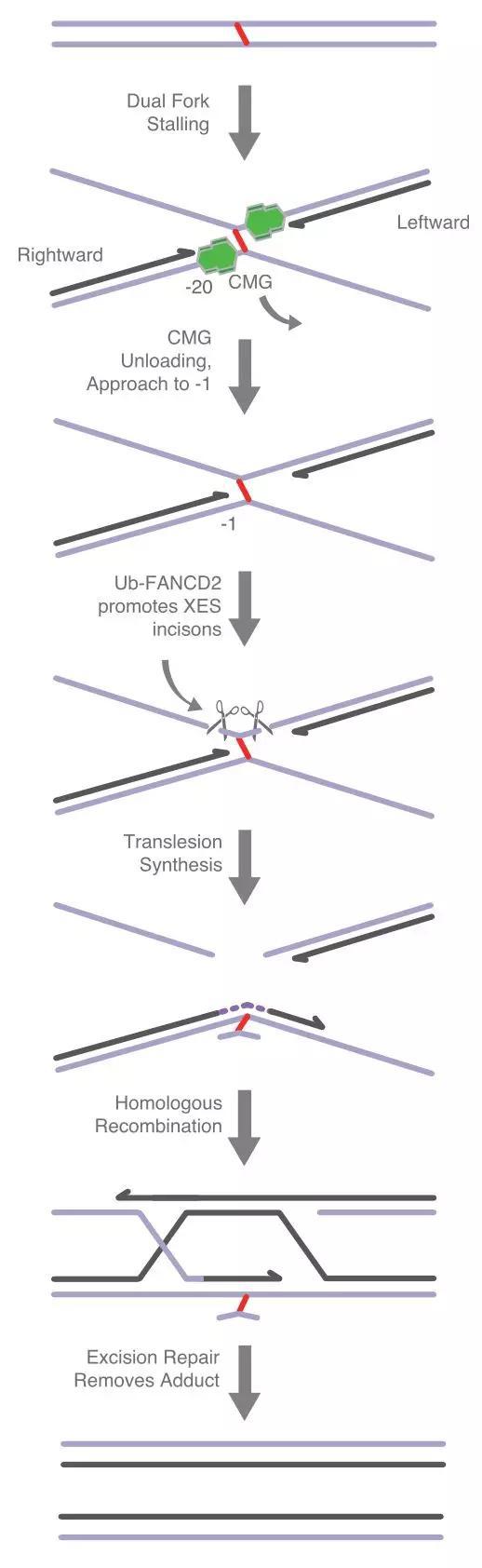
▲ FA通路的修复方式:红色短线是DNA交联损伤位点。
注意看那两把大剪刀
显然,FA通路用粗暴的方式帮DNA解了围,随后细胞还会启动其他机制去修复被剪断的DNA。从这个过程中,你不难看出,FA通路那一刀,直接导致DNA断裂,虽然后续有其他的修复机制帮它收场,但是仍旧存在很大的风险,有可能会导致染色体重排,这样一来正常的细胞就有可能癌变了。
总的来看FA通路这个修复方式,虽然有风险,但是总算修复了可怕的DNA交联损伤。有研究表明,顺铂诱导的DNA交联损伤,就可以通过这种方式修复[5]。
那乙醛导致的DNA交联损伤是不是也可以用这种方式修复呢?
上面这个问题才是荷兰皇家科学院Hubrecht研究所的Puck Knipscheer和英国MRC分子生物学实验室的Ketan J。 Patel团队想要的研究课题。

▲ Puck Knipscheer(来源:hubrecht.eu)
研究乙醛导致的DNA交联损伤修复方式的难点在于,乙醛诱导的特定位点DNA交联损伤很难获得。他们解决这个问题就花了两三年的时间[6]。
获取他们想要的DNA交联损伤之后,Knipscheer和Patel团队深入研究了它的修复方式。
FA通路确实参与了。
不过,他们意外地发现,除了FA通路,好像还有一个更快的修复机制存在,大约有一半的乙醛诱导的DNA交联是未知的修复方式修复的。
他们的职业敏感性告诉他们,下面有条大鱼。

▲ Ketan J。 Patel(来源:hubrecht.eu)
深入的研究发现,他们观察到的第二种DNA交联修复方式也与DNA复制有关,但确实与FA无关。
围绕这个未知的修复方式,Knipscheer和Patel团队的研究人员展开了深入的研究。结果发现,这个未知的修复方式不仅比FA通路快,还更安全:它竟然没有切断交联位点附近的DNA链,而是直接把链子的一端解开了。
最终呈现的结果就是,经过这个未知的DNA交联损伤修复方式修复之后,交联位点的一条链上的碱基是正常的,对面那条链上对应的碱基携带着那个乙醛诱发的“链子”。(如下图所示)
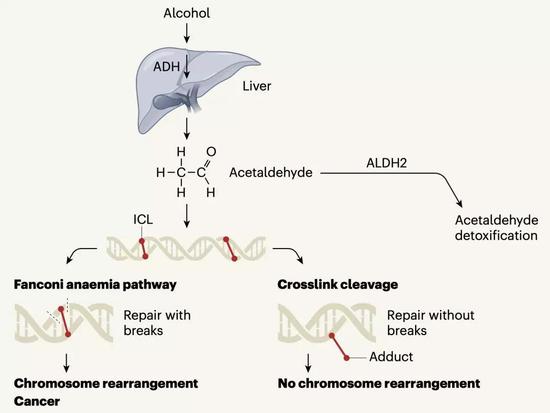
▲ 图中红色短线是DNA交联损伤位点 左下角是FA修复方式,右下角是新发现的修复方式
很显然,这个新的修复机制无需切断DNA,比FA通路安全多了。
Knipscheer和Patel团队还发现,这个未知的修复方式虽然能修复乙醛诱导的DNA交联损伤,但是对于顺铂诱导的DNA交联损伤却无能为力。
遗憾的是,Knipscheer和Patel团队虽然观察到了这种修复途径的存在,但不知道它究竟是如何发生的,有哪些分子参与其中。
如果后续研究能找到这种修复方式背后的分子机制,有望开发相应的药物治疗范可尼贫血,以及降低酒精性癌症的发病率,甚至还有可能发现另一个身患范可尼贫血样疾病的人群。




